Seis formas en que la FIV cambió el mundo, de Louise Brown hasta la investigación de células madre.
El primer bebé de “probeta” cumple 40 años este mes, pero el impacto de la fertilización in vitro se extiende mucho más allá de las soluciones a los problemas de fertilidad.
1. Normalización de la concepción en una placa de Petri
Suena bastante perverso y arcaico hoy en día llamar a un niño nacido por FIV un “bebé de probeta”. La técnica de la reproducción asistida se ha generalizado y normalizado, más de 6 millones de bebés en el camino, que no hay nada tan extraordinario o estigmatizante en haber sido concebido en una placa de Petri (“in vitro” significa, en vidrio). En muchos países del mundo, el 3-6% de todos los niños ahora están concebidos de esta manera.
Dado el grado de escepticismo y oposición que enfrentaba la FIV cuando todavía era un campo de investigación no probado y algo especulativo a fines de la década de 1960, es sorprendente cuán rápidamente se aceptó. La técnica fue iniciada por el fisiólogo de Cambridge Robert Edwards, trabajando con el obstetra Patrick Steptoe del hospital general de Oldham, quien informó por primera vez de la fertilización exitosa de un óvulo humano in vitro en 1969. La pareja se enfrentó a una oposición inmensa. Eminentes biólogos y médicos, incluidos premios Nobel, descartaron su trabajo como científicamente inútil, innecesario y éticamente cuestionable, y el Consejo de Investigación Médica no lo financió. El fisiólogo Martin Johnson, estudiante graduado de Edwards en la década de 1960, admitió que inicialmente se mostró reacio a unirse a él y Steptoe porque “fue bastante inquietante … ver el nivel de hostilidad hacia su trabajo”. Sin embargo, después de lograr la concepción en una placa de Petri, los investigadores perfeccionaron el método para uso clínico, que culminó con el nacimiento de Louise Brownin Oldham el 25 de julio de 1978. Edwards recibió el Premio Nobel de Medicina o Fisiología por su trabajo en 2010, pero Steptoe murió en 1988
El nacimiento de Louise Brown transformó la opinión pública. La gente ahora podía ver que un “bebé probeta” era como cualquier otro. Periódicos que habían advertido previamente cómo la FIV amenazaba el bienestar humano y la dignidad se convirtieron repentinamente en adoradores del bebé sentimentales, anunciando el “bebé del siglo”. “Ella es hermosa”, dijo el Daily Express, “ese es el bebé de probeta”. Después de sus pronósticos distópicos, los medios se confundieron por la normalidad de todo. Sea testigo de la disonancia cognitiva en el titular de Newsweek: “Nació alrededor de las 11:47 p.m. con un grito, y fue un grito en torno al valiente nuevo mundo”.
2. Abrir la puerta de acceso a una comprensión más profunda de la reproducción humana.
Al crear más óvulos fertilizados que los que generalmente se reimplantan en el útero, la FIV produce “embriones sobrantes” que pueden usarse, con consentimiento para la investigación científica. Esta noción de “repuestos” que podría tener el potencial de convertirse en un ser humano (aunque muchos no) sigue pareciendo moralmente repugnante para algunas personas. Otros aceptan que los embriones “en exceso” son inevitables si la FIV logra buenos índices de éxito, y sienten que hay una justificación para usarlos para avanzar en la comprensión científica y brindar beneficios médicos, en lugar de descartarlos. En cualquier caso, la FIV ha hecho posible un campo completo de investigación con embriones humanos.
Dichos estudios no solo pueden ayudar a mejorar la FIV en sí, sino que también pueden conducir a una mejor comprensión de, por ejemplo, las causas del aborto espontáneo precoz o los defectos del crecimiento. “La investigación en embriones humanos ha cambiado nuestra comprensión fundamental de la genética de la biología celular”, dice Alison Murdoch, profesor de medicina reproductiva en la Universidad de Newcastle. “Además de ayudarnos a comprender por qué la fertilidad de la especie humana es tan singularmente mala, la investigación ha extendido las aplicaciones de la embriología humana más allá del tratamiento clínico de la infertilidad para la prevención de otros problemas médicos”.
El HFEA impone límites estrictos a lo que se puede hacer con embriones humanos. El informe de Warnock advirtió que no deberían utilizarse en investigaciones posteriores a los 14 días posteriores a la fecundación, un punto de corte que siempre se reconoció como algo arbitrario, aunque se eligió en parte porque hay un claro marcador biológico. En esta etapa, los embriones desarrollan la “veta primitiva”, el primer signo de lo que se convertirá en la columna vertebral, después de lo cual ya no pueden convertirse en gemelos. Entonces en un sentido frio, después de 14 días la “personalidad” del embrión se vuelve determinada. Pero los avances recientes han hecho posible, en principio, mantener los embriones viables in vitro por más de 14 días, reabriendo la discusión sobre si la regla de los 14 días debería extenderse. Actualmente no hay planes para hacerlo.
3. Allanando el camino para la investigación con células madre
Debido a la oposición teológica y ética a la investigación con embriones, la investigación con células madre comenzó mucho después de que la FIV comenzó en 1978. Realmente comenzó a despegar después del aislamiento de las células madre embrionarias humanas (HESCs) en 1998. “De repente, todas las agencias de financiación querían se invitó a las clínicas a participar pidiéndoles a sus pacientes que donen embriones excedentes “, dice Murdoch.
En sus primeras etapas, los embriones están formados por células madre, que pueden convertirse en cualquier tipo de tejido en el cuerpo. Las generaciones posteriores de células se especializan: células del corazón, músculos, neuronas, etc. Debido a su versatilidad, los HESC se pueden usar para cultivar tejidos para la medicina regenerativa. Los esfuerzos para tratar enfermedades como la enfermedad cardíaca o el Parkinson mediante la inyección de células madre en los respectivos tejidos se están sometiendo a ensayos clínicos en humanos. En los EE. UU., Tales terapias con células madre se han visto obstaculizadas por la decisión de la administración de George W. Bush en 2001 de que la investigación que utilizaba nuevas líneas de HESC tomadas de embriones de IVF no podría ser financiada por el gobierno federal. Dichos usos de los embriones fueron considerados no éticos por el conservador panel de asesoría bioética de Bush.
A pesar de tales obstáculos, dice Murdoch, desde 2000 “la ciencia de HESC hizo un buen progreso, y el Reino Unido fue prominente en esta investigación”. El grupo de Murdoch en Newcastle ha sido pionero en las técnicas de transferencia mitocondrial, cuyos descendientes se denominan engañosamente “bebés de tres padres”, para combatir las enfermedades mitocondriales heredables y debilitantes. “Si no hubiéramos tenido la experiencia previa en embriología humana (in vitro) y en el manejo de los desafíos éticos y regulatorios de la investigación de HESC, probablemente nunca hubiésemos podido lograr esto”, dice ella. Tales avances han sido ayudados por el marco regulatorio permisivo pero ajustado de la HFEA. “No es accidental que el Reino Unido sea el primer país del mundo en licenciar edición genética en investigación y donación mitocondrial en tratamiento”, dice Thompson.
4. Nos obligó a pensar en la detección genética
En 1990, poco antes del debate de Commons sobre el Proyecto de Ley de Fertilización Humana y Embriología, los expertos en fertilidad británicos Robert Winston y Alan Handyside revelaron que habían analizado embriones para determinar su sexo, lo que aumentaba la posibilidad de detectar embriones para una enfermedad específica de un sexo. Esto ayudó a persuadir a algunos escépticos de que la investigación con embriones, después de todo, una sólida motivación médica.
De hecho, ya se ha informado de un análisis genético más detallado de las células extraídas de los embriones para buscar genes vinculados a la enfermedad. Este método, llamado diagnóstico genético preimplantacional (DGP), ahora está permitido por el HFEA para detectar alrededor de 400 enfermedades graves asociadas con genes únicos (como la fibrosis quística), de modo que no se implantarán embriones portadores de variantes génicas relacionadas con la enfermedad, eliminando el riesgo de transmitir la enfermedad a parejas que saben que son portadores del gen. Pero la tecnología de detección de genes también alimenta los temores de los bebés de diseño, seleccionados para no evitar las enfermedades, sino porque tienen genes que se cree que están relacionados con rasgos deseables como la inteligencia y el atletismo.
5. Nos dio una nueva visión de la concepción humana
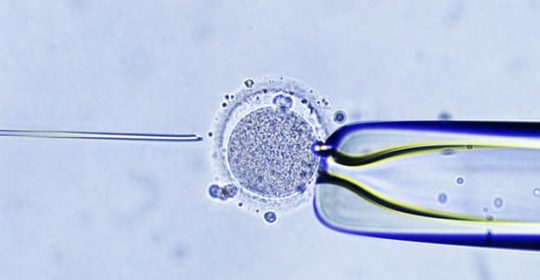
La fertilización de un óvulo humano por un espermatozoide fue observada por primera vez bajo el microscopio 99 años antes de que naciera Louise Brown, por el zoólogo suizo Hermann Fol. Pero fue solo cuando el desarrollo del óvulo fertilizado pudo ser sostenido y seguido, el inicio de la FIV en 1969, que el embrión humano, ese pequeño grupo de células que se convirtió en el emblema del comienzo de la vida. Pocas historias de medios sobre reproducción asistida ahora están completas. La imagen igualmente icónica de un espermatozoide que se inyecta a través de una micropipeta en el óvulo suave y flexible en la variante de FIV llamada inyección intracitoplásmica de esperma (ICSI) es en sí misma una especie de recapitulación estilizada de las relaciones sexuales. Estas imágenes se muestran como imágenes milagrosas de esperanza, incluso mientras, paradójicamente, nos confrontan con una visión de la vida humana profundamente ajena a nuestra experiencia. La socióloga Sarah Franklin de la Universidad de Cambridge dice que las micrografías de ICSI reconfiguran nuestra noción de vida como algo que puede ser mediado tecnológicamente. “Después de haber pasado por FIV, ni la reproducción humana ni la biología reproductiva tienen el mismo aspecto”, dice. “La FIV ha cambiado la comprensión científica de lo que es la vida”.
La técnica también ha cambiado las nociones tradicionales de estructura familiar. La donación de óvulos y la subrogación, la congelación de embriones y técnicas como la transferencia mitocondrial y la edición del genoma alteran los puntos de vista sostenidos sobre las relaciones biológicas, el parentesco y las limitaciones de tiempo, espacio, género y genética en la procreación.
6. Se inició un nuevo debate sobre el estado moral del embrión
Mientras el embrión permanezca fuera de la vista, todo tipo de narraciones podrían girar en torno a su estado moral, tradicionalmente, para la iglesia católica, girando en torno al tema de cuándo adquirió un alma. Pero cuando la biología quedó al descubierto, se necesitaban nuevas historias. Como ha señalado la politóloga Rosalind Petchesky, los antiabortistas han enmarcado cada vez más estos en términos biológicos. ¿Es la personalidad una cuestión de identidad genética única?
La ironía es que, incluso cuando la biología se une a los argumentos morales, muestra el desarrollo como una serie de pasos, ninguno obviamente más “fundamental” que los demás. Por lo tanto, el estado moral del embrión sigue siendo polémico.

